首页 产品 实验室部门
FOB4独立式实验室灭菌器是一种高压灭菌器,它将卓越的性能与全面优质的材料和易用性结合在一起。
FOB4实验室灭菌器适用于多种不同的实验室应用,例如:
- 微生物学和分析实验室。
- 研究机构和检验机构。
- 生物技术和生命科学。
- 动物设施和临床诊断实验室。
- 制药、食品、化学工业、质量控制实验室。
- 医院手术室和医疗保健。农业、环境和兽医实验室。
这些灭菌器经过特殊设计,具有“人体工程学特性”,便于处理更大体积的灭菌材料和物品,如:在开放和密封的容器中的玻璃器皿、介质制备、液体、混合的常规和高风险废物,以及手术器械、纺织品、橡胶用品等医院用品和包装工具。
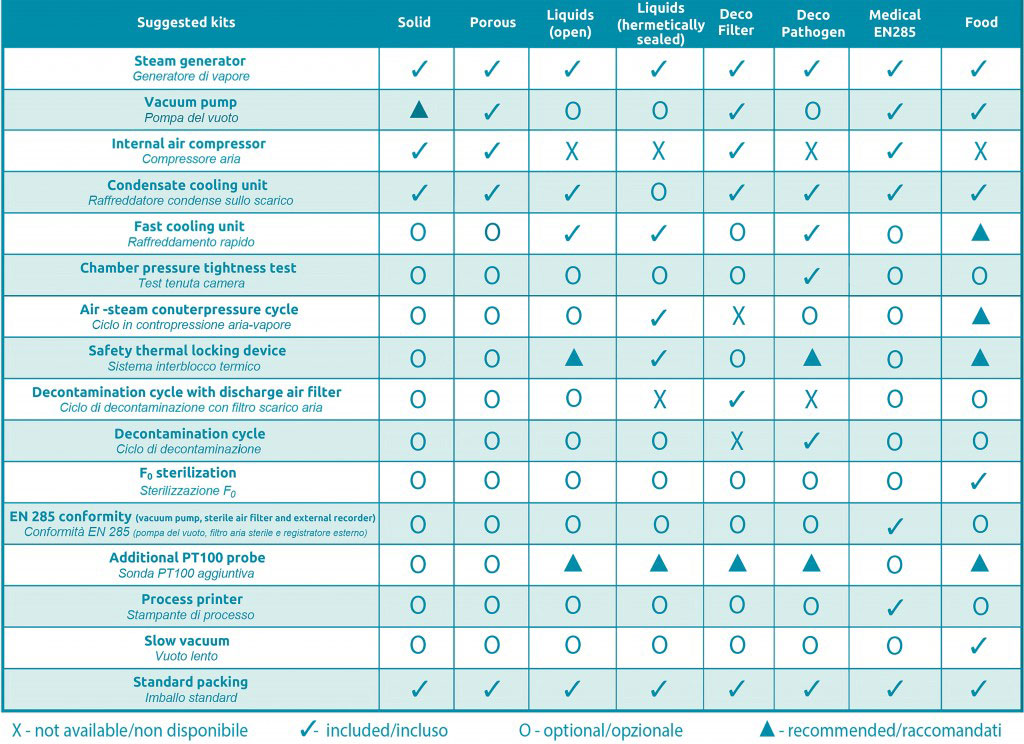
FOB4独立式实验室灭菌器易于配置,这得益于其概念设计和模块化结构以及方便的可选工具包组合。 事实上,所有型号都可以使用各种定制系统进行配置,这些定制系统由大范围的过程、软件选项和大范围的附件选择作为保证。 请点击“建议工具包”链接,查看有关FOB4系列的所有可能配置。
设计和技术特点
FOB4可设计为两个腔体尺寸:带单垂直推拉门的147升(FOB4-TS, 226升 (FOB4L) 腔体,或带双垂直推拉门的210升(FOB4S-TS–FOB4/L TS)腔体,它们都用于传递目的。 实验室和医院的垂直自动推拉门是气动激活的,以提高空间效率。
FOB4高压灭菌器内部有AISI 316L不锈钢板,由蒸汽给料,既可用作蒸汽预热的换热系统,也可用冷软化水冷却腔室温度。 作为一种选择,这些板件可用于循环结束时的干燥目的。
Fedegari设计的实验室高压灭菌器结合了操作人员的安全以及设备性能。 FOB4符合TRB402标准,安装的热阻塞系统可以防止在危险情况下将门打开。 温度探头和压力传感器确保恒定的过程监控,以及腔体内的精确度和最佳温度分布,确保操作人员的高度安全,以及灭菌过程的性能和可重复性。
FOB系列配有DCS20过程控制器:30个周期,在多用户环境下易于定制。 大型触摸屏彩色显示屏和通过以太网控制进行远程监控的接口。 DCS20过程控制器已经被充分验证和文件记录。
主要优点
- 节能、节水、节约成本。
- 具有卓越装载能力的小机器型号。
- 操作显示器可以根据人体工程学进行定位。
- 从正面和侧面可以非常方便地进入技术区域。
- 用于消毒器效率例行检查的特殊测试程序。
- 符合GAMP5。
- >符合GLP
CONFORME A:
- Standard UNI EN ISO: 9001:2015, 13485:2016
- Direttive Europee: 97/23/CE – Dispositivi a pressione (PED), 93/42/EEC – Dispositivi medici (MD), 2004/108/EEC – Compatibilità elettromagnetica (EMC), 2006/95/EC – Sicurezza elettrica (LVD), 2006/95/EC – Dispositivi macchine (MD)
- Standard europei: EN ISO 12100, EN IEC 61010-1, EN IEC 61010-2-040
- ASME: Stamp R, Stamp S, Stamp U
- Standard cinese: SELO
- Standard svizzero: SR 930.114
- FDA
下载
相关产品
您需要什么帮助?
DCS20
DCS20过程控制器是Fedegari专门为实验室设备设计的。
这是一个模块化的系统,提供了广泛的功能和高可靠性。
系统包括一个监控模块和其他专用于特定功能的单独模块,例如:程序管理,循环,阶段组,配置和模块报警。
选项
- 远程界面允许通过以太网连接到PC。此连接允许操作员在PC桌面上查看设备显示状态。
- 远程控制允许通过以太网接口连接到PC。此连接允许操作员与设备完全交互。不包括关门和数据备份操作。
数据管理符合21 CFR PART 11协议的要求。
生命周期和验证
DCS20是根据当前GMP中规定的监管要求,按照规定的生命周期设计、开发、测试、维护和验证的。
生命周期管理符合FDA 21 CFR Part 11的要求,按照GAMP5指南的原则定义产品管理。
根据GAMP5 – 附录M4软件和硬件类别中的定义,DCSPLUS 20系统分类如下:
- 软件类别4 – 可配置的系统
- 硬件类别1 – 标准硬件组件
在项目和工程活动期间,根据ALCOA+原则应用功能风险分析,对软件和硬件组件进行测试,如变更控制程序中定义的专用于DCS20 ,作为Fedegari质量体系的一部分。